มวลอะตอม
เนื่องจากอะตอมของแต่ละธาตุมีมวลน้อยมาก เช่น อะตอมของไฮโดรเจนมีมวล 1.66 * 10-24 กรัม
อะตอมของออกซิเจนมีมวล2.65 * 10-23 กรัม ทำให้ไม่สามารถชั่งมวลของธาตุ 1 อะตอมได้โดยตรง
ดอลตันจึงได้พยายามหามวลอะตอมของแต่ละธาตุโดยใช้วิธีการเปรียบเทียบว่าอะตอมาตุชนิดหนึ่งมีมวลเป็นกี่ท่าของอะตอมของอีกธาตุหนึ่งที่กำหนดให้เป็นมาตรฐาน
ดอลตันได้พบว่าไฮโดรเจนเป็นธาตุที่อะตอมมีมวลน้อยที่สุด จึงเสนอให้ใช้ไฮโดรเจนเป็นธาตุมาตรฐานในการเปรียบเทียบเพื่อหามวลอะตอมของธาตุอื่นๆโดยกำหนดให้ไฮโดรเจน 1 อะตอมมีมวลเป็น 1 หน่วย ด้วยวิธีการเช่นนี้ อะตอมของคาร์บอนมีมวลเป็น 12 เท่าของไฮโดรเจนก็จะมีมวลเป็น12 หน่วย อะตอมของออกซิเจนมีมวลเป็น 16 เท่าของไฮโดรเจนก็จะมีมวลเป็น 16 หน่วย ตัวเลขที่ได้จากการเปรียบเทียบมวลของธาตุ 1 อะตอมกับมวลของธาตุมาตรฐาน 1 อะตอม เรียกว่า มวลอะตอมของธาตุ
ต่อมานักวิทยาศาสตร์จึงได้ตกลงใช้คาร์บอน-12 ซึ่งเป็นไอโซโทปหนึ่งของคาร์บอนเป็นมาตรฐานในการเปรียบเทียบมวล เนื่องจากธาตุคาร์บอนสามารถทำปฏิกิริยากับธาตุอื่นๆ เกิดเป็นสารประกอบได้เป็นจำนวนมาก และคาร์บอน-12 เป็นไอโซโทปที่มีปริมาณสูงกว่าไอโซโทปอื่นๆ ของคาร์บอนอีกด้วย โดยกำหนดให้คาร์บอน-12 จำนวน 1 อะตอมมีมวล 12 หน่วยมวลอะตอม ดังนั้น 1 หน่วยมวลอะตอมจึงมีค่าเท่ากับ 1/12 มวลของคาร์บอน-12 จำนวน 1 อะตอมหรือเท่ากับ1.66 * 10-24 กรัม ค่าของมวลอะตอมของธาตุจึงเขียนเป็นความสัมพันธ์ไดดังนี้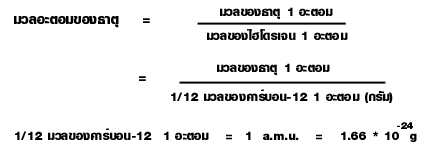
มวลอะตอมของคาร์บอนที่คำนวณได้นี้เป็นค่ามวลอะตอมที่เฉลี่ยของคาร์บอนซึ่งสอดคล้องกับค่ามวลอะตอมของธาตุที่ปรากฏอยู่ในธรรมชาติ ดังนั้นค่ามวลอะตอมของธาตุใดๆ ในตารางธาตุจึงเป็นค่ามวลอะตอมเฉลี่ยซึ่งขึ้นอยู่กับค่ามวลอะตอมและปริมาณของแต่ละไอโซโทปที่พบอยู่ในธรรมชาติ
ปัจจุบันนี้นักวิทยาศาสตร์จึงหามวลอะตอมและปริมาณของไอโซโทปของแต่ละธาตุ โดยใช้เครื่องมือเรียกว่าแมสสเปกโตรมิเตอร์ ทำให้ได้ค่าที่แน่นอนและมีความถูกต้องสูง
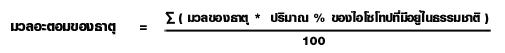
การหามวลอะตอมของธาตุ กรณีที่กำหนด%ไอโซโทปในธรรมชาติ
| ไอโซโทป | %ที่มีในธรรมชาติ | มวลอะตอม |
| 3Li6 | 7.00 | 6.0200 |
| 3Li6 | 93.00 | 7.0100 |
ในกรณีที่ไม่ทราบชนิดและจำนวนอะตอมของธาตุที่เป็นองค์ประกอบในโมเลกุลของสาร แต่ทราบมวลเป็นกรัมของสาร1 โมเลกุล จะหามวลโมเลกุลของสารได้จากความสัมพันธ์ดังนี้
- ใช้การเปรียบเทียบเช่นเดียวกับการหามวลอะตอม

2. คิดจากผลบวกของอะตอมของธาตุต่าง ๆ ที่เป็นองค์ประกอบใน 1 โมเลกุลของสารนั้น
มวลโมเลกุล CuSO4*5H2O = 63.5 + 32 + (4x16) + (5x18) = 249.5โมลโมล เป็นหน่วยบอกจำนวนอนุภาคของสาร ซึ่งหมายถึงปริมาณของสารที่มีจำนวนอนุภาคเท่ากับจำนวนอะตอมของคาร์บอน-12ที่มีมวล 12 กรัม เราทราบแล้วว่าคาร์บอน-12 จำนวน 1 อะตอม มีมวล 12.00 * 1.66 * 10-24 กรัม
ดังนั้น เราสามารถคำนวณหาจำนวนอะตอมของคาร์บอน-12 ที่มีมวล 12 กรัมได้ โดยสมมุติให้คาร์บอน 12 กรัมมีจำนวนอนุภาคเท่ากับ a อะตอม เมื่อเขียนในรูปอัตราส่วนที่เท่ากับอัตราส่วนแรกจะเป็นดังนี้
แสดงว่าคาร์บอน-12 ที่มีมวล 12 กรัม ประกอบด้วยอะตอมของคาร์บอน 6.024096 * 1023 อะตอม จำนวน 6.02 * 1023 นี้เรียกว่า เลขอาโวกาโดร และกำหนดให้สารที่มีจำนวนอนุภาคเท่ากับเลขอาโวกาโดร คิดเป็นปริมาณ1 โมล ดังนั้น
สาร 1 โมลมี 6.02 * 1023 อนุภาค
สาร 2 โมลมี 2 * 6.02 * 1023 อนุภาค
สาร 0.5 โมลมี 0.5 * 6.02 * 1023 อนุภาค

การบอกปริมาณของสารเป็นโมล จะทำให้ทราบจำนวนอนุภาคของสารนั้นได้
ปริมาณของสารในหน่วยโมลมีความสัมพันธ์กับปริมาณอื่นๆดังนี้
- จำนวนโมลของสาร
ธาตุใดๆ ที่มีปริมาณ 6.02 * 1023 อะตอมหรือ 1 โมล จะมีมวลเป็นกรัมเท่ากับมวลอะตอมของธาตุนั้นๆ เช่น แมกนีเซียมมีมวลอะตอมเท่ากับ 24.3 ดังนั้นแมกนีเซียม 1 โมลหรือ 6.02 * 1023 อะตอมจะมีมวล 24.3
สารใดๆ 1 โมลหรือ 6.02 * 1023 โมเลกุลจะมีมวลเป็นกรัมเท่ากับมวลโมเลกุลของสารนั้น เช่น
คลอรีนมีมวลโมเลกุลเท่ากับ 71 ดั้งนั้นคลอรีน 1 โมลหรือ 6.02 * 1023 โมเลกุลจะมีมวล 32 กรัม
2. ปริมาตรต่อโมลของก๊าซ
ปริมาตรของก๊าซเปลี่ยนแปลงตามอุณหภูมิและความดัน การบอกปริมาตรของก๊าซจึงต้องระบุอุณหภูมิและความดันไว้ด้วย นักวิทยาศาสตร์กำหนดให้ อุณหภูมิ 25 องศาเซลเซียส และความดัน 1 บรรยากาศ เป็นภาวะมาตรฐาน(StandardTemperature and Pressure) และเรียกย่อว่า STP เช่นก๊าซออกซิเจน 32 กรัม (ปริมาณ 1 โมล) มีปริมาตรเท่ากับ22.4 ลูกบาศก์เดซิเมตรที่ STP หรือกล่าวอีกนัยหนึ่งว่าปริมาตรต่อโมลของก๊าซออกซิเจนมีค่า 22.4 ลูกบาศก์เดซิเมตรที่STP
สารละลาย
สารละลาย (Solution) คือ สารเนื้อเดียวที่มีสารตั้งแต่ 2 ชนิดขึ้นไปมารวมกัน ประกอบด้วยตัวทำละลายและตัวถูกละลายถ้าตัวถูกสารละลายและตัวทำละลายมีสถานะเดียวกันสารละลายที่มีปริมาณมากกว่าเป็นตัวทำละลาย แต่ถ้าสารทั้งสองมีสถานะแตกต่างกันสารที่มีสถานะเดียวกันกับสารละลายเป็นตัวทำละลาย
หน่วยของสารละลาย เป็นค่าที่แสดงถึงปริมาณของตัวละลายที่ละลายอยู่ในตัวทำละลายหรือในสารละลายนั้นวัดในรูปความเข้มข้นปริมาณตัวถูกละลายต่อปริมาณสารละลาย (ยกเว้นหน่วยโมลต่อกิโลกรัม)
1. ร้อยละ1.1 ร้อยละโดยมวล(มวล/มวล) คือ ปริมาณมวลของตัวถูกละลายในมวลของสารละลาย 100 หน่วยมวล
1.2 ร้อยละโดยปริมาตร(ปริมาตร/ปริมาตร) คือ ปริมาตรของตัวถูกละลายในสารละลายปริมาตร 100 หน่วยปริมาตร นิยมใช้กับสารละลายที่เป็นของเหลว เช่น สารละลายแอลกอฮอล์เข้มข้นร้อยละ 20 โดยปริมาตร หมายความว่าสารละลายนี้100 ลูกบาศก์เซนติเมตรจะมีแอลกอฮอล์ละลายอยู่ 20 ลูกบาศก์เซนติเมตร
1.3 ร้อยละมวลต่อปริมาตร คือ ปริมาณของตัวถูกละลายในปริมาตรของสารละลาย 100 หน่วยปริมาตร โดยทั่วไปถ้ามวลของตัวถูกละลายมีหน่วยเป็นกรัมปริมาตรของสารละลายจะมีหน่วยเป็นลูกบาศก์เซนติเมตร และถ้ามวลของตัวถูกละลายมีหน่วยเป็นกิโลกรัม ปริมาตรของสารละลายจะมีหน่วยเป็นลูกบาศก์เดซิเมตรหรือลิตร หน่วยมวลและหน่วยปริมาตรต้องให้สอดคล้องกันด้วย2. โมลาริตี หรือโมลต่อลูกบาศก์เดซิเมตร (mol/dm3 หรือ mol/l) เป็นหน่วยที่บอกจำนวนโมลของตัวถูกละลายในสารละลาย 1 ลูกบาศก์เดซิเมตร หน่วยความเข้มข้นเป็นโมลต่อลูกบาศก์เดซิเมตรอาจเรียกย่อได้เป็นโมลาร์(Molar) ใช้สัญลักษณ์ M
3. โมแลลิตี หรือ โมลต่อกิโลกรัม (mol/kg) เป็นหน่วยที่บอกจำนวนโมลของตัวถูกละลายที่ละลาย ในตัวทำละลาย1 กิโลกรัม จึงมีหน่วยเป็น mol/kg หรือเรียกว่า โมแลล (Molal) ใช้สัญลักษณ์ m
4. เศษส่วนโมล (Mole fractions) คือ สัดส่วนจำนวนโมลของสารองค์ประกอบหนึ่งต่อจำนวนโมลรวมของสารทุกชนิดในสารละลาย ใช้สัญลักษณ์ X เช่น สารละลายชนิดหนึ่งประกอบด้วยสาร A a mol, B b mol และC c mol จะได้เศษส่วนโมลของสาร A, B และ C ดังนี้
เศษส่วนโมลของสาร A (XA) = a / ( a + b + c )
เศษส่วนโมลของสาร B (XB) = b / ( a + b + c )
เศษส่วนโมลของสาร C (XC) = c / ( a + b + c )
ผลรวมของเศษส่วนโมลของสารองค์ประกอบทั้งหมดคือ XA + XB + XC มีค่าเท่ากับ 1และเมื่อนำค่าเศษส่วนโมลของแต่ละสารมาคูณด้วยร้อย จะได้ความเข้มข้นในหน่วยร้อยละโดยมวลของสารนั้นร้อยละโดยมวลของสาร A = เศษส่วนโมลของสาร A * 100
ร้อยละโดยมวลของสาร B = เศษส่วนโมลของสาร B * 100
ร้อยละโดยมวลของสาร C = เศษส่วนโมลของสาร C * 1005. ส่วนในล้านส่วน (parts per million; ppm) เป็นหน่วยที่บอกมวลของตัวถูกละลายที่ละลายอยู่ในสารละลาย1 ล้านหน่วยมวลเดียวกัน ซึ่งเป็นหน่วยความเข้มข้นของสารละลายที่เจือจางมาก ๆ
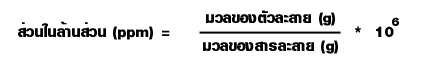 หรืออาจใช้แสดงปริมาณของสิ่งเจือปนที่มีอยู่ในสารเคมีที่บริสุทธิ์ต่างๆ เช่น สารละลายโพแทสเซียมไนเตรตเข้มข้น 2 ppm หมายความว่ามีโพแทสเซียมไนเตรตเป็นตัวละลาย 2 ส่วน(กรัม) ละลายอยู่ในสารละลาย 1 ล้านส่วน (กรัม) หรือ 106 กรัม
หรืออาจใช้แสดงปริมาณของสิ่งเจือปนที่มีอยู่ในสารเคมีที่บริสุทธิ์ต่างๆ เช่น สารละลายโพแทสเซียมไนเตรตเข้มข้น 2 ppm หมายความว่ามีโพแทสเซียมไนเตรตเป็นตัวละลาย 2 ส่วน(กรัม) ละลายอยู่ในสารละลาย 1 ล้านส่วน (กรัม) หรือ 106 กรัม
สรุปสูตรการคำนวน
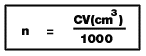 6. สารละลายที่มีความเข้มข้น C mol/dm3 จำนวน V cm3 จำนวนโมลของตัวถูกละลาย n mol
6. สารละลายที่มีความเข้มข้น C mol/dm3 จำนวน V cm3 จำนวนโมลของตัวถูกละลาย n mol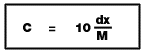 7.1 ร้อยละโดยมวล ---------> mol/dm3
7.1 ร้อยละโดยมวล ---------> mol/dm3X = ความเข้มข้น (% โดยมวล) M = มวลโมเลกุลของตัวถูกละลาย
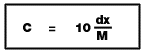 7.2 ร้อยละโดยปริมาตร --------------> mol/dm3
7.2 ร้อยละโดยปริมาตร --------------> mol/dm3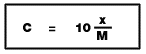 8.3 ร้อยละโดยมวลต่อปริมาตร ---------------> mol/dm3
8.3 ร้อยละโดยมวลต่อปริมาตร ---------------> mol/dm38. การเตรียมสารละลายเจือจางโดยการเติมน้ำ
โมลของตัวถูกละลายก่อนเติมน้ำ = โมลของตัวถูกละลายหลังเติมน้ำ
สารละลาย C1 mol/dm3 จำนวน V1 cm3 เติมน้ำเป็นสารละลาย C2 mol/dm3 จำนวน V2 cm3
สูตรเกี่ยวกับสารละลายที่มีสมบัติคอลลิเกตีฟ
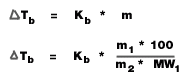
- จุดเดือดTb = จุดเดือดของสารละลาย - จุดเดือดของตัวทำละลาย (องศาเซลเซียส)
Kb = ค่าคงที่ของการเพิ่มขึ้นของจุดเดือดของสารละลาย (องศาเซลเซียส/mol/kg)
m = ความเข้มข้นของสารละลาย (mol/kg)
m1 = มวลตัวถูกละลาย (g)
m2 = มวลของตัวทำละลาย (g)
MW1 = มวลโมเลกุลของตัวถูกละลาย
- จุดหลอมเหลว (หรือจุดเยือกแข็ง)
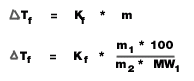
Kf = ค่าคงที่ของการลดลงของจุดเยือกแข็งของสารละลาย (องศาเซลเซียส/mol/kg)
3.สารละลายชนิดเดียวกันมีความเข้มข้นเท่ากัน จุดเดือดและจุดเยือกแข็งสัมพันธ์กันดังนี้
1. ระบบปิด คือ ระบบที่ไม่มีการถ่ายเทมวลของสารระหว่างระบบกับสิ่งแวดล้อม
2. ระบบเปิด คือ ระบบที่มีการถ่ายเทมวลของสารระหว่างระบบกับสิ่งแวดล้อม
การศึกษาการเปลี่ยนแปลงของสารจำเป็นต้องระบุสมบัติต่างๆ ของระบบ เช่น มวล อุณหภูมิ ปริมาตร ความดัน ถ้าตรวจสอบได้ว่าสมบัติใดของระบบมีการเปลี่ยนแปลงก็ถือได้ว่ามีการเปลี่ยนแปลงเกิดขึ้นในระบบ สมบัติของสารและปัจจัยที่มีผลต่อสมบัติของระบบเรียกว่าภาวะของระบบ
ในปี พ.ศ. 2317 อองตวน-โลรอง ลาวัวซิเอ ได้ทดลองเผาสารในหลอดที่ปิดสนิทพบว่า มวลรวมของสารก่อนเกิดปฏิกิริยาเท่ากับมวลรวมของสารหลังทำปฏิกิริยา จึงตั้งเป็นกฎเรียกว่า กฎทรงมวล
โจเชฟ เพราสต์ ได้ศึกษาการเตรียมสารประกอบบางชนิด
พบว่าสารประกอบชนิดหนึ่งที่เตรียมด้วยวิธีการที่แตกต่างกันมีอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่งๆ จะมีค่าคงที่ จึงตั้งเป็นกฎเรียกว่า กฎสัดส่วนคงที่ ตัวอย่างเช่น สารประกอบคอปเปอร์(II)ซัลไฟด์ ( CuS ) ที่เกิดจากการรวมตัวของทองแดงและกำมะถันจะมีอัตราส่วนโดยมวลเท่ากับ2:1 เสมอ
ปริมาตรก๊าซในปฏิกิริยาเคมี
ก๊าซมีสมบัติฟุ้งกระจายและมีมวลน้อยมาก การวัดมวลโดยตรงทำได้ยากจึงนิยมวัดในหน่วยปริมาตรซึ่งสามารถอธิบายโดยใช้กฎดังต่อไปนี้
1. กฎของเกย์ลุสแซกในปี พ.ศ. 2531 โซเซฟ-ลุย-เก-ลูซัก
ได้ทดลองวัดปริมาตรของก๊าซที่ทำปฏิกิริยาพอดีกันและปริมาตรของก๊าซที่ได้จากปฏิกิริยาณ อุณหภมิและความดันเดียวกัน แล้วสรุปเป็นกฎการรวมปริมาตรของก๊าซว่า "ในปฏิกิริยาเคมีที่เป็นก๊าซ อัตราส่วนโดยปริมาตรของก๊าซที่ทำปฏิกิริยาพอดีกันและปริมาตรของก๊าซที่เกิดจากปฏิกิริยาที่อุณหภูมิและความดันเดียวกัน จะเป็นเลขจำนวนเต็มลงตัวน้อย ๆ"
2. กฎอาโวกาโดรในปี พ.ศ. 2354 อาเมเดโอ อาโวกาโดร ได้ศึกษากฎของเกย์-ลูสแซกและอธิบายว่าการที่อัตราส่วนโดยปริมาตรของก๊าซที่เข้าทำปฎิกิริยาและที่ได้จากปฏิกิริยาเป็นเลขจำนวนเต็มน้อยๆคงเป็นเพราะปริมาตรของก๊าซมีความสัมพันธ์กับจำนวนอนุภาคที่รวมตัวกันเป็นสารประกอบ อาโวกาโดรจึงเสนอสมสุติฐานว่า"ที่อุณหภูมิและความดันเดียวกัน ก๊าซทุกชนิดที่มีปริมาตรเท่ากันจะมีจำนวนโมเลกุลเท่ากัน"เช่น ปฏิกิริยาระหว่างก๊าซไฮโดรเจนกับก๊าซออกซิเจนจนเกิดเป็นไอน้ำ
ไฮโดรเจน + ออกซิเจน -------> ไอน้ำ
2 โมเลกุล 1 โมเลกุล 2 โมเลกุล
ในปฏิกิริยาเดียวกันนั้น เช่นN2(g) + 3H2(g) ------> 2NH3(g)อัตราส่วนโดยปริมาตร N2 : H2 : NH3 = 1 : 3 : 2
อัตราส่วนโดยโมล N2 : H2 : NH3 = 1 : 3 : 2
การหาสูตรเอมพิรีคัล
สูตรเอมพิริคัล เป็นสูตรที่แสดงอัตราส่วนอย่างต่ำของธาตุองค์ประกอบ เช่น ไฮโดรเจนเปอร์ออกไซด์มีสูตรโมเลกุลเป็น H2O2 อัตราส่วนอย่างต่ำของจำนวนอะตอม H : O เท่ากับ 1 : 1 สูตรเอมพิริคัลจึงเป็น HOกลูโคสมีสูตรโมเลกุลเป็น C6H12O6 อัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O เท่ากับ 1 : 2 : 1 สูตรเอมพิริคัลจึงเป็น CH2O
การหาสูตรเอมพิริคัล มีหลักดังนี้
1. ต้องทราบว่าสารที่จะหาสูตรเอมพิริคัลประกอบด้วยธาตุใดบ้าง2. ต้องทราบมวลอะตอมของแต่ละธาตุในสารที่จะหาสูตรเอาพิริคัล
3. ต้องทราบมวลของแต่ละธาตุในสารที่จะหาสูตร
4. ให้ข้อมูลจากข้อ 1, 2 และ 3 หาอัตราส่วนโดยโมล ด้วยการนำมวลของแต่ละธาตุหารด้วยมวลอะตอมของมันมาเข้าอัตราส่วน
5. สำหรับการปัดจุดทศนิยมของตัวเลขในการหาอัตราส่วนโดยโมล โดยทำตัวเลขใดตัวเลขหนึ่ง ให้เป็น 1 แล้วจึงปัดจุดทศนิยมด้วยวิธีปัด 0.1 - 0.2 ทิ้ง ถ้าเป็น 0.8 - 0.9 ปัดขึ้นอีก 1 ถ้าเป็น 0.0 - 0.7
ปัดไม่ได้ต้องหาตัวเลขที่ต่ำที่สุดมาคูณตัวเลขของอัตราส่วนโดยโมลให้มีค่าใกล้กับที่จะปัดจุดทศนิยมได้ แล้วปัดจุดทศนิยมตัวเลขให้เป็นจำนวนเต็ม อนึ่งการปัดจุดทศนิยม ถ้าตัวเลขปัดจุดทศนิยมไม่ได้
ตัวเลขทุกตัวของอัตราส่วนโดยโมลนั้นก็จะไม่ปัดจุดทศนิยม หาตัวเลข มาคูณให้ได้ตัวเลขที่จะปัดจุดทศนิยมได้อัตราส่วนโดยโมลที่เป็นจำนวนเต็มได้สูตรเอมพิริคัล
การหาสูตรโมเลกุลของสารทั่วไปสูตรโมเลกุลเป็นสูตรที่แสดงจำนวนอะตอมของธาตุองค์ประกอบที่มีอยู่ใน 1 โมเลกุลของสาร เช่น
ไฮโดรเจนมีสูตรโมเลกุลเป็น H2 แสดงว่า 1 โมเลกุลประกอบด้วยไฮโดรเจน 2 อะตอม ไฮโดรเจนเปอร์ออกไซด์มีสูตรโมเลกุลเป็น H2O2 แสดงว่า
1 โมเลกุลประกอบด้วยไฮโดรเจนและออกซิเจนธาตุละ 2 อะตอม
การหาสูตรโมเลกุลของสารทั่วไป มีหลักดังนี้1. ต้องทราบสูตรเอมพิริคัล
2. ต้องทราบมวลโมเลกุลโดยโจทย์กำหนดมาให้ทางตรงหรือทางอ้อมก็ได้
3. นำข้อมูลที่ได้จากข้อ 1, 2 หาค่า n โดยใช้สูตร
(มวลของสูตรเอมพิริคัล) x n = มวลโมเลกุล
n = เลขเป็นจำนวนเต็มบวก เช่น 1, 2, 3การปัดจุดทศนิยมของค่า n ตั้งแต่ 0.5 ขึ้นไป ให้ปัดขึ้นอีกหนึ่ง แต่ถ้าต่ำกว่า 0.5 ก็ปัดทิ้งไป เช่น 3.6
ก็ให้ปัดจุดทศนิยมเป็น4.0 และ 2.2 ปัดจุดทศนิยมเป็น 2.0
การหาสูตรโมเลกุลของก๊าซ และการหาร้อยละโดยมวลของธาตุจากสูตรเคมี
การหาสูตรโมเลกุลของก๊าซ มีหลักการดังนี้1. สารทุกชนิดที่เกี่ยวข้องในปฏิกิริยาเป็นก๊าซหมด และสารที่จะหาสูตรโมเลกุลจะต้องเป็นก๊าซหรือไอเท่านั้น
2. สมมติสูตรโมเลกุลของก๊าซที่จะหาสูตรโดยทราบว่าประกอบด้วยธาตุใดบ้าง
3. ต้องทราบปริมาตรของก๊าซต่าง ๆ ที่เกี่ยวข้องกันในปฏิกิริยา และปริมาตรของก๊าซต้องวัดที่อุณหภูมิและความดันเดียวกัน
4. หาอัตราส่วนโดยปริมาตรก๊าซต่าง ๆ เป็นอย่างต่ำ
5. เปลี่ยนอัตราส่วนโดยปริมาตรของก๊าซเป็นอัตราส่วนโดยโมล โดยใช้กฎอาโวกาโดร
6. เขียนสมการของปฏิกิริยาเคมีตามโจทย์บอก แล้วเข้าสมการพีชคณิตของจำนวนอะตอมทั้งหมด ทางซ้ายและทางขวาของแต่ละธาตุให้เท่ากัน จะได้สมการพีชคณิตหลายสมการที่มีตัวแปรหลายตัว
จากนั้นก็คำนวณหาสูตรโมเลกุลของก๊าซได้
การหาร้อยละโดยมวลของธาตุจากสูตรเคมี
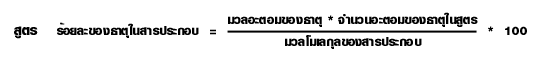
ความสัมพันธ์ระหว่างปริมาณของสารในสมการเคมี
สำหรับปฏิกิริยาที่เป็นก๊าซล้วน ๆ สามารถใช้สัมประสิทธิ์ของก๊าซต่าง ๆ ในสมการ มาอ่านเป็นปริมาตรได้ แต่ต้องที่อุณหภูมิและความดันเดียวกัน
N2(g) + 3H2(g) ------> 2NH3(g) ที่อุณหภูมิ และความดันเดียวกัน
ปริมาตร (หน่วยปริมาตร) 1 3 2
การคำนวณเกี่ยวกับสมการเคมี มีหลักทั่วไปดังนี้
1. ต้องทราบสมการของปฏิกิริยาเคมีพร้อมดุล2. พิจารณาเฉพาะสารที่โจทย์ถาม และกำหนดให้
3.แล้วนำสิ่งที่โจทย์กำหนดให้มาคิดคำนวณหาสิ่งที่ต้องการจากสมการได้โดยการเทียบบัญญัติไตรยางค์ ด้วยการใช้ความรู้เรื่องโมลหรืออาจจะคำนวณด้วยวิธีหนึ่งโดยนำจำนวนโมลของสารที่โจทย์ถามและโจทย์กำหนดให้มาเทียบอัตราส่วนกันจะเท่ากับจำนวนโมลที่เป็นสัมประสิทธิ์ของสารที่โจทย์ถามและโจทย์กำหนดให้ตามสมการ
สารกำหนดปริมาณ (Limiting Reagent) และร้อยละของผลได้ของสารผลิตภัณฑ์
สารกำหนดปริมาณ (Limiting Reagent)สารที่เข้าทำปฏิกิริยามีปริมาณไม่พอดีกัน ปฏิกิริยาที่เกิดขึ้นจะสิ้นสุดเมื่อสารใดสารหนึ่งหมดสาร
ที่หมดก่อนจะเป็นตัวกำหนดปริมาณของผลิตภัณฑ์ของสารผลิตภัณฑ์ที่เกิดขึ้นเรียกว่าสารกำหนดปริมาณ (Limiting Reagent)
สารกำหนดปริมาณในการเกิดปฏิกิริยาเป็นการคำนวณสารจากสมการของปฏิกิริยาที่โจทย์บอกข้อมูลเกี่ยวกับสารตั้งต้นมาให้มากกว่าหนึ่งชนิด ลักษณะโจทย์มี 2 แบบ คือ
1. โจทย์บอกข้อมูลของสารตั้งต้นมาให้มากกว่าหนึ่งชนิด แต่ไม่บอกข้อมูลเกี่ยวกับสารผลิตภัณฑ์
ในการคำนวณต้องพิจารณาว่าสารใดถูกใช้ทำปฏิกิริยาหมด แล้วจึงใช้สารนั้นเป็นหลักในการคำนวณสิ่งที่ต้องการจากสมการได้
2. โจทย์บอกข้อมูลของสารตั้งต้นมาให้มากกว่าหนึ่งชนิด และบอกข้อมูลของสารผลิตภัณฑ์ชนิด
ใดชนิดหนึ่งมาให้ด้วย
ในการคำนวณให้ใช้ข้อมูลจากสารผลิตภัณฑ์เป็นเกณฑ์ในการเทียบหาสิ่งที่ต้องการจากสมการเคมี
ร้อยละของผลได้ของสารผลิตภัณฑ์ในการคำนวณหาปริมาณของผลิตภัณฑ์จากสมการเคมีนั้น ค่าที่ได้เรียกว่า ผลได้ตามทฤษฎี
(Theoretical yield) แต่ในทางปฏิบัติจะได้ผลิตภัณฑ์น้อยกว่าตามทฤษฎี แต่จะได้มากหรือน้อยแค่ไหน ก็ขึ้นอยู่กับวิธีการและสารเคมีที่ใช้ เรียกผลที่ได้ว่านี้ ผลได้จริง (Actual yield)
สำหรับการรายงานผล การทดลองนั้น จะเปรียบเทียบค่าที่ได้ตามทฤษฎีในรูปร้อยละ
ซึ่งจะได้ความสัมพันธ์ดังนี้
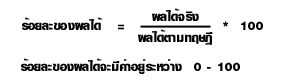
http://kienakrab.tripod.com/cgi-bin/47.htm